
A.S.S.O
Associazione a Sostegno degli Studi Oncologici - ONLUS
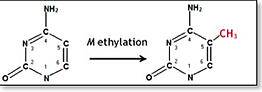
Mirco Fanelli............tutti quei meccanismi che non coinvolgono cambiamenti della sequenza del DNA ma alterazioni della struttura di cui il DNA fa parte (cromatina). Queste modificazioni epigenetiche sono alla base del normale funzionamento delle nostre cellule sane e governano la vita dal suo sviluppo embrionale sino alla maturazione delle cellule nell’adulto. Tuttavia, per motivi ancora poco noti, alcune cellule possono ereditare delle perturbazioni della struttura cromatinica che determinano, a lungo termine, la perdita del controllo dei normali processi biologici.La metilazione del DNA è probabilmente la modificazione epigenetica più caratterizzata e consiste semplicemente nell’aggiunta di un gruppo chimico denominato metile (-CH3) in una posizione precisa della base citosina.Queste regioni sono distribuite nel genoma prevalentemente nelle regioni ripetute pericentromeriche e nelle regioni che regolano la trascrizione (il funzionamento) dei geni. Mentre in prossimità dei centromeri la metilazione delle CpG concorre a mantenere la struttura centromerica e donare stabilità al genoma, in prossimità dei promotori genici la metilazione contribuisce al silenziamento genico. Così un gene ipermetilato nel suo promotore tende ad essere trascrizionalmente inattivo e, al contrario, un promotore ipometilato è generalmente associato a trascrizione genica.Ecco come le nostre cellule imparano ad esprimere alcuni geni e reprimerne altri ed ecco come le cellule staminali embrionali sono istruite per svolgere il loro lavoro nell’organismo adulto.Purtroppo, alterazioni dei livelli di metilazione del genoma umano sono state osservate in tutti i tipi di tumore. In particolare sembra che la cellula normale possa progressivamente rendere instabile il proprio genoma a causa della perdita di metilazione delle regioni ripetute pericentromeriche e, nel contempo, cambi la distribuzione della metilazione a livello dei promotori genici. In questo modo la cellula si trova a reprimere l’espressione di tutti quei geni chiamati oncosoppressori (i freni della replicazione cellulare) attraverso la loro ipermetilazione e, viceversa, acquisisca l’espressione anomala dei protoncogeni (gli acceleratori della replicazione cellulare) perdendo la loro metilazione.Negli ultimi anni sono state identificate e studiate nuove molecole abili ad inibire gli enzimi deputati al trasferimento del gruppo metile sulla base citosina (le DNA metiltransferasi o DNMTs). Attraverso meccanismi abbastanza complessi, queste molecole sembrano in grado di ridurre la ipermetilazione dei geni oncosoppressori e ristabilirne quindi l’espressione, Così facendo, la cellula neoplastica riacquisisce la capacità di rallentare la propria proliferazione fino ad arrestarsi. Inoltre, gli inibitori della metilazione sono anche in grado d’indurre il suicidio cellulare (tipo di morte noto con il nome di “apoptosi” o “morte cellulare programmata”).Molte di queste nuove strategie demetilanti per la cura del cancro sono attualmente in fase di studio clinico ............
DNA Demethylating Antineoplastic Strategies
- Mirco Fanelli, Molecular Pathology and Oncology Lab. “PaoLa,” Department of Biomolecular Sciences, University of Urbino “Carlo Bo,” Via Arco d’Augusto 2, 61032 Fano (PU), Italy Email: mirco.fanelli@uniurb.it
Abstract
Despite the involvement of genetic alterations in neoplastic cell transformation, it is increasingly evident that abnormal epigenetic patterns, such as those affecting DNA methylation and histone posttranslational modifications (PTMs), play an essential role in the early stages of tumor development. This finding, together with the evidence that epigenetic changes are reversible, enabled the development of new antineoplastic therapeutic approaches known as epigenetic therapies. Epigenetic modifications are involved in the control of gene expression, and their aberrant distribution is thought to participate in neoplastic transformation by causing the deregulation of crucial cellular pathways. Epigenetic drugs are able to revert the defective gene expression profile of cancer cells and, consequently, reestablish normal molecular pathways. Considering the emerging interest in epigenetic therapeutics, this review focuses on the approaches affecting DNA methylation, evaluates novel strategies and those already approved for clinical use, and compares their therapeutic potential.

Nessun commento:
Posta un commento